研究内容
当研究室では、ウイルス感染に対する防御機構の理解とその応用を目指し、以下の主要な研究テーマに取り組んでいます。
ウイルス感染に対するヒトの自然免疫応答
私たちの体には、ウイルスや細菌などの病原体を異物として認識し、排除するための高度な免疫機構が備わっています。免疫は大きく自然免疫と獲得免疫に分けられますが、特に自然免疫は、受容体タンパク質を介して宿主由来の「自己」分子を認識せず、病原体分子の特徴を「非自己」として特異的に認識します。当研究室では、細胞内に存在する免疫受容体に焦点を当てて研究を進めています。
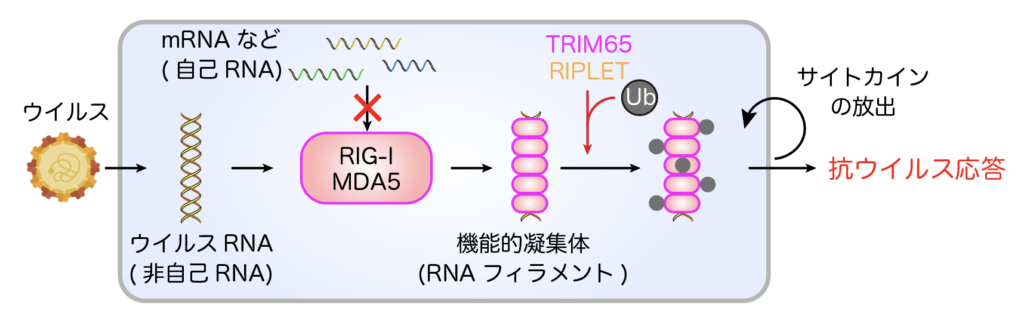
RIG-I様受容体(RIG-I, MDA5)は、細胞内に侵入したウイルスRNAを認識し、RNAフィラメントと呼ばれる凝集体構造を形成します(図1)。これにより、下流のシグナルが活性化され、インターフェロンと呼ばれる強力なサイトカインが産生され、宿主は抗ウイルス状態を獲得します。この「自己」と「非自己」の区別は厳密に制御される必要があり、その破綻は自己免疫疾患の発症を引き起こします。
現在、以下のプロジェクトに取り組んでいます:
1. RIG-IやMDA5が自己/非自己RNAを厳密に区別し、凝集体構造を形成するメカニズムの解明
RIG-IやMDA5による免疫応答には、さまざまなコファクタータンパク質や翻訳後修飾が関与し、「非自己」のウイルスRNAに対してのみ免疫応答が起こることが明らかになってきました(Kato et al., Mol Cell, 2021, https://www.cell.com/molecular-cell/pdf/S1097-2765(20)30889-3.pdf)。すなわち、RIG-IやMDA5による免疫応答は複数のチェックポイントによって階層的に制御されています(図2, 3)。当研究室ではこれらのコファクタータンパク質がどのようなメカニズムでRIG-I/MDA5の機能を制御しているかに注目して研究をおこなっています。
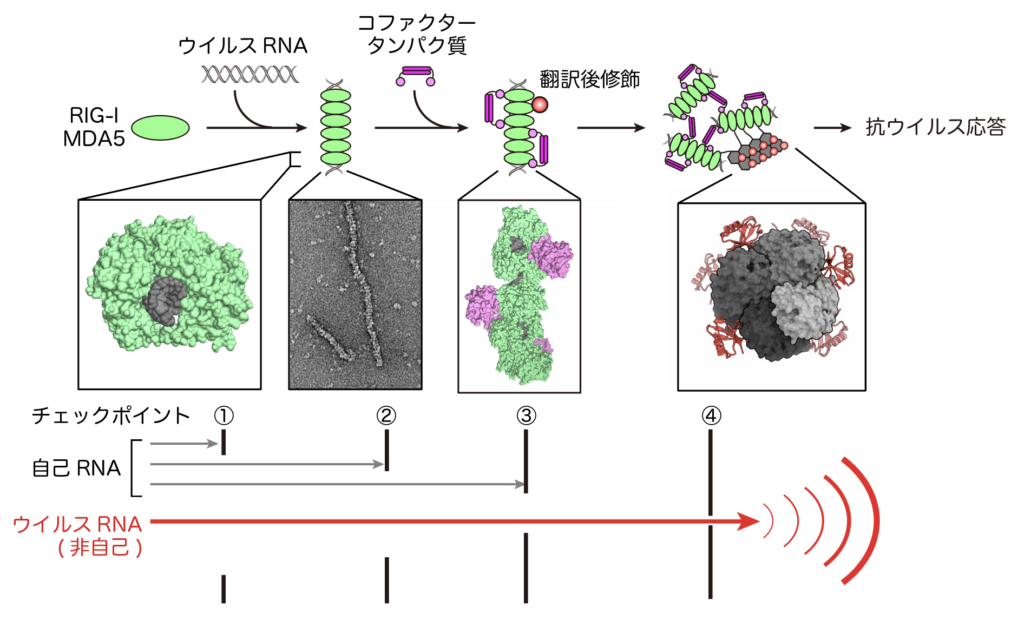
RIG-I/MDA5による抗ウイルス免疫応答では、「自己」と「非自己」RNAを見分けるための複数のチェックポイントが存在する。① ウイルスRNAに特徴的な構造を特異的に認識する。② 凝集体(フィラメント)を形成することでウイルスRNAの長さを認識している。③ コファクタータンパク質(TRIM65やRIPLET)がRNAフィラメントのみを認識し、翻訳後修飾(ユビキチン化)をおこなう。④ ユビキチン化が下流のシグナルを増強する。
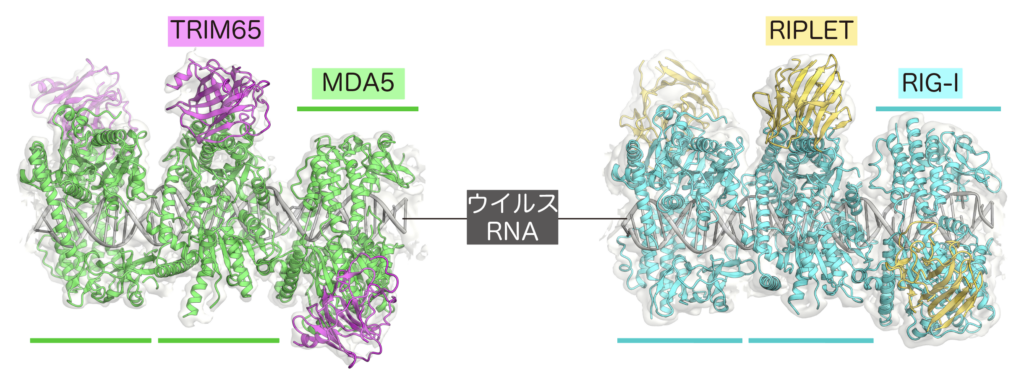
(左) MDA5-RNA-TRIM65.(右) RIG-I-RNA-RIPLET
2. RIG-I/MDA5変異による自己免疫疾患発症メカニズムの解明、および治療薬の開発
RIG-I/MDA5の変異がヒトにおいて報告されています。これらのRIG-I/MDA5変異体は機能獲得型変異体として、「自己」RNAを誤って認識してしまい、ウイルス感染状態でないにもかかわらず免疫応答を惹起します。その結果、シングルトン・メルテン症候群、糖尿病やエカルディ・グティエール症候群などの自己免疫疾患を引き起こします。当研究室では、これらのRIG-I/MDA5変異体がどのように「自己」RNAを誤って認識してしまうのか?そのメカニズムに焦点を当てて研究しています。さらに得られた知見に基づいて自己免疫疾患の治療薬の開発をおこなっています。
3. 自己抗体による自己抗原認識機構の解明
抗体もまた細菌やウイルスを「非自己」として直接認識し排除します。しかしながら自己免疫疾患などの患者では、しばしば抗体が自己抗原を誤って認識してしまうことが報告されています。当研究室では、実際に自己抗体を単離し、自己抗原を間違って認識してしまうメカニズムの解明をおこなっています。
原核生物の抗ファージ防御機構を利用した新規ツール開発
バクテリアはわたしたちの体内に侵入すると様々な感染症を引き起こしますが、バクテリア自身もまたファージウイルスに対する感染の脅威に晒されています。地球上にはおよそ数百万種類もの原核生物(バクテリアや古細菌)が存在すると考えられており、各々の原核生物はファージウイルスの感染に対抗するため、多様な防御システムを進化させてきました。CRISPR-Cas(クリスパーキャス)機構は原核生物の獲得免疫機構で、Cas酵素を介してファージウイルスの感染を抑えます。これまでに多種多様なCas酵素が発見され、ライフサイエンス分野の基礎研究から医療・産業分野に至るまで広く利用されてきました。例えばS.pyrogenesというバクテリアから発見されたCas9はガイドRNAを目印にして、特定のDNA配列を切断します。Cas9はゲノム遺伝子を切断する「はさみ」として、動物や植物の遺伝情報を自由に書き換えることができることから、ゲノム編集技術の分野にパラダイムシフトを起こしました(図4)。
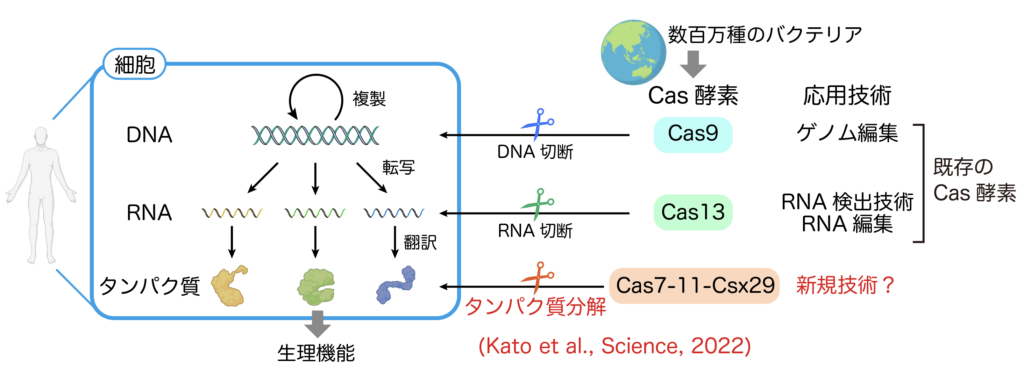
これまでに発見されたCas酵素は、DNAやRNAといった核酸を切断するものばかりで、タンパク質を切断するCas酵素は発見されていませんでした。私は前所属先である東京大学 先端科学技術研究センター 西増弘志教授のもとで、プロテアーゼ型のCas酵素、Cas7-11を見つけました(Kato et al., Science, 2022, https://www.science.org/doi/10.1126/science.add7347)。Cas7-11はCsx29プロテアーゼ、ガイドRNAと複合体を形成し、標的RNAを認識するとプロテアーゼ活性を示します(図5)。当研究室では国内外のアカデミアや企業との共同研究によって、Cas7-11-Csx29のプロテアーゼ活性をヒト細胞に応用して新しい技術の開発を目指しています。
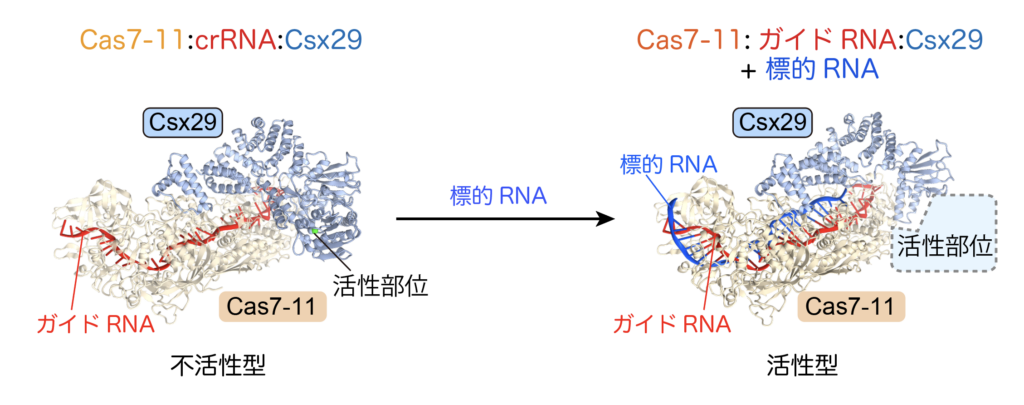
Cas7-11-Csx29複合体は、通常はプロテアーゼ不活性型として存在し(左)、標的RNAの結合に伴い活性型となる。
研究方法
これらの研究を進める上で、私たちはまず研究対象となるタンパク質を組み換えタンパク質として発現・精製することから始めます。
(生化学的解析)
そうして得られた精製タンパク質やRNAを試験管の中 (in vitro) で混合し、酵素反応や結合実験などの生化学的実験によってそれらの機能を詳しく調べます。試験管の中ですと、化合物の有無やpHや塩濃度などの反応条件を好きに設定できるので、目的タンパク質の機能を詳しく調べることができます。そうして新しい生命現象を探していきます。
(細胞生物学的解析)
細胞を用いた実験によって、より生理的な条件で検証します。研究対象のタンパク質をコードする遺伝子をノックアウトもしくは外来プラスミドとして遺伝子導入することで、下流の遺伝子の発現レベルの変化、免疫応答や細胞死などをアウトプットとして測定します。
(構造生物学的解析)
研究対象のタンパク質の立体構造を実際に目で視ることで、その機能やメカニズムをより詳しく知ることができます。タンパク質の立体構造を原子分解能レベルで決定する手法として以前はX線結晶構造解析が主流でしたが、タンパク質を結晶化するためにときには大変な労力と時間がかかっていました。最近では、クライオ電子顕微鏡を用いることでタンパク質の立体構造を簡単に決定できる様になりました。当研究室では生化学実験や細胞実験で発見した新規の生命現象について、主にクライオ電子顕微鏡を用いて立体構造を決定し、詳しいメカニズムを調べています。


